

Las aneuploidías (ganancias o perdidas parciales, o totales de los cromosomas) del embrión pueden llevar a fallas de implantación, detenimiento del desarrollo y pérdidas espontáneos del embarazo. En general, estas se originan durante la formación de las células reproductivas, y son frecuentes a medida que avanza la edad materna. El PGT-A se indica en parejas con edad materna avanzada, cuando han habido pérdidas repetidas del embarazo, fallas recurrentes de implantación, y en casos de infertilidad masculina.
El PGT-A no invasivo (niPGT-A) realizado a partir de la amplificación y secuenciación del ADN libre de células liberado al medio de cultivo, es una herramienta genómica de última generación para la identificación de embriones euploides antes de la transferencia.
Ventajas del niPGT-A

El PGT no invasivo de Aneuploidías (niPGT-A) convierte en innecesaria la biopsia embrionaria para el estudio genético del embrión, manteniendo de este modo su integridad a lo largo de todo el proceso de desarrollo.


Procedimiento
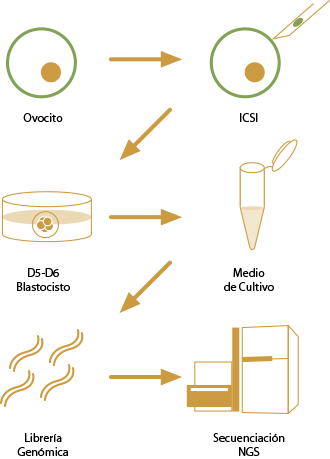
ADN embrionario libre de células

Mosaicismo

Análisis Bioinformático

Contaminación

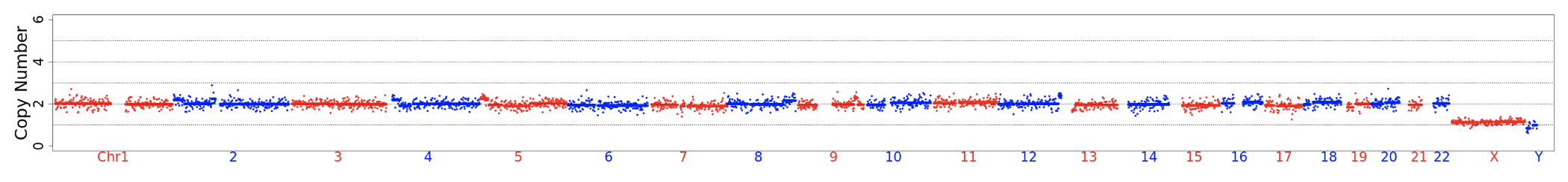
Resultados

Valores publicados



Referencias
- Rubio, C. et al., 2020. Multicenter prospective study of concordance between embryo cell-free DNA and trophectoderm biopsies from 1,301 human blastocysts. American Journal of Obstetrics and Gynecology, doi:10.1016/j.ajog.2020.04.035
- Kuznyetsov, V. et al., 2020. Minimally Invasive Cell-Free Human Embryo Aneuploidy Testing (miPGT-A) Utilizing Combined Spent Embryo Culture Medium and Blastocoel Fluid –Towards Development of a Clinical Assay. Scientific Reports, pp.1–12.
- Huang, L., et al (2019). Noninvasive preimplantation genetic testing for aneuploidy in spent medium may be more reliable than trophectoderm biopsy. PNAS 110, 201907472–8.
- Rubio C, et al (2019). Embryonic cell-free DNA versus trophectoderm biopsy for aneuploidy testing: concordance rate and clinical implications. Fertil Steril. 112(3):510-519.
- Kuznyetsov, V., et al. 2018. Evaluation of a novel non-invasive preimplantation genetic screening approach. PloS One, 13(5), e0197262.
- WeiQiang, L., et al. (2017). Non-Invasive Pre-Implantation Aneuploidy Screening and Diagnosis of Beta Thalassemia IVSII654 Mutation using Spent Embryo Culture Medium. Annals of Medicine. 49(4):319-328.
- Xu J, et al. (2016) Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization. PNAS USA; 113: 11907.
- Huang, L., et al (2015). Single-Cell Whole-Genome Amplification and Sequencing: Methodology and Applications. Ann. Review of Genomics and Human Genetics, 16(1), 79–102.
+54 9 11 2815 3338
Av. Corrientes 3360. Piso 11. Ciudad Autónoma de Buenos Aires (CABA). C1193AAS. Argentina
Biocódices Copyright 2022




